나녹스(nnox) 투자기_4, FDA 510k 절차
FDA 승인을 기다리면서 FDA 510k에 대한 절차를 공부하게 되었다.
언제나 그렇듯이 선매수 후공부
(이번 투자를 계기로 선공부 후매수로 성향이 바뀌게 되었다)
우선 언제 510k를 제출하는지 FDA 사이트에 명기되어 있다.
https://www.fda.gov/medical-devices/premarket-submissions-selecting-and-preparing-correct-submission/premarket-notification-510k
Premarket Notification 510(k)
Information about Premarket Notification 510(k)s.
www.fda.gov
간단하게 미국에서 완제품의 의료기기를 팔고 싶다면 시판 전 하가를 받아야 한다.
https://www.fda.gov/medical-devices/premarket-notification-510k/510k-submission-process
510(k) Submission Process
Premarket Notification (510(k)) submissions for medical devices are reviewed by FDA’s Center for Devices and Radiological Health (CDRH).
www.fda.gov
상세한 절차는 다음과 같다.
1. 접수

승인 신청할 경우 일련번호가 부여된다. K+연도 두자리+일련번호 4자리가 부여된다. 예로 23년도 첫번째 신청건은 K230001 이 된다.
여기서 7일 안에 승인 절차 진행 비용을 납입해야하고 납입하지 않을 경우 180 캘린더 데이(주말 포함한 날짜) 가 지날때까지 처리하지 않으면 취소가 된다. 뭐 보통 신청해놓고 납입 안할 일은 없지 않을까 한다.
납입이 되면 acknowledgement letter를 발급하는데, 영수증 같은 개념이라고 보면 되겠다. 이를 악용하여 FDA 절차가 진행된것처럼 보이게하는 경우도 있는지 이건 마케팅 자료로 쓰지 말라고 써있다.

2. 검토 시작

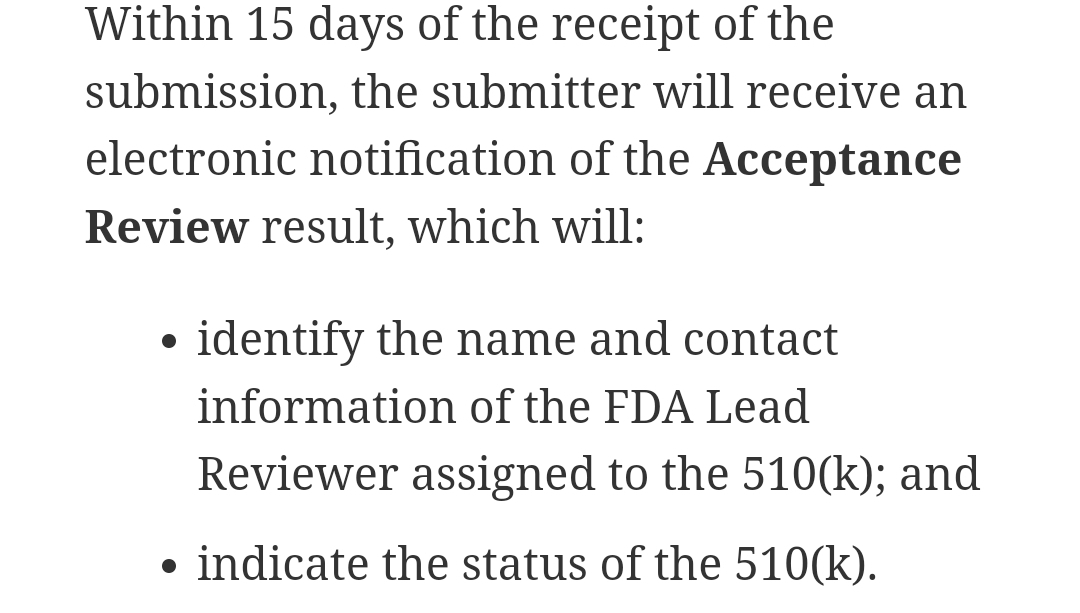
접수 후 15일 안에 이 승인 요청건을 수행할 것인지를 검토한다.

검토 결과는 당연하겠지만 검토를 진행한다, 검토를 진행하지 않는다로 결론이 나고, 진행할지 말지 좀더 검토해야한다 라는 3가지 케이스로 결론이 난다고 한다.
검토하기로 결정할 경우 Substantive review, 굳이 한국말로 번역한다면 본검토로 넘어간다.
3. Substantive review

본검토 단계에 들어가면 60일간 검토가 진행된다.
FDA 리뷰어가 제출자와 질의응답을 거쳐 1차 결론을 내게되는데 우선 Interactive Review, 발견한 결함에 대해 상호 연락을 통해 검토해나가는 과정, 두번째로 제출 절차를 hold 하고 additional information 즉 절차를 멈추고 추가적인 자료를 제출하는 선택을 하게된다.
통상 interactive review는 중대한 결함이 없어 질의응답으로 해결할 수 있는 상태라고 보면 되고,
additional information은 승인 절차를 멈춰야 하는 좀더 중대한 결함이 있는 경우라고 인지하면 되겠다.

Interactive review는 이메일이나 전화(요즘은 줌 같은 화상 회의도 할듯하다) 로 진행된다고 한다.
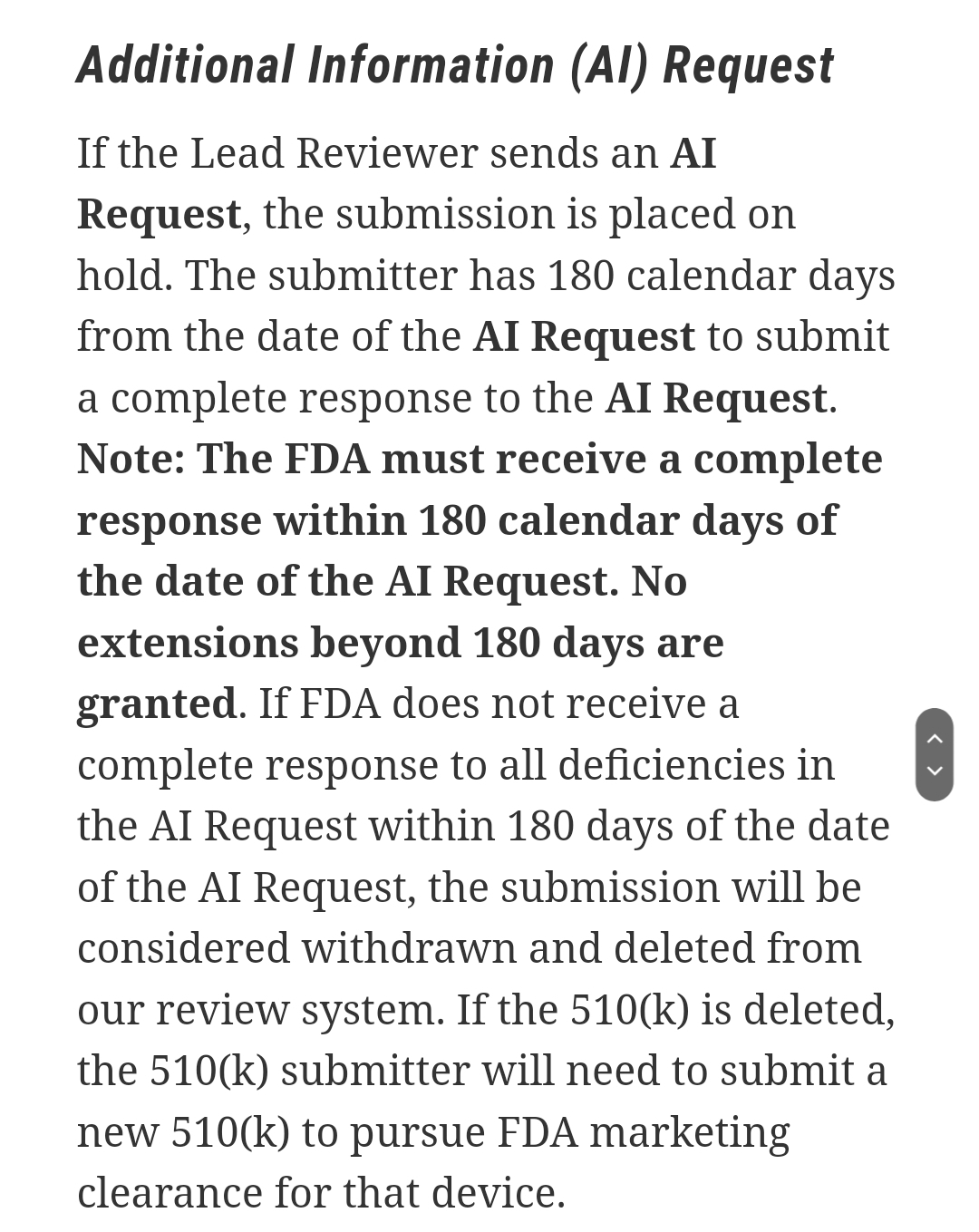
AI request 절차의 경우 검토를 멈추고 180일 안에 추가 자료를 제출해야한다. 그렇지 않을 경우 승인 검토건은 자동으로 취소된다.
4. Decision letter

마지막은 최종 결론이다. SE(substantion equivalent) 와 NSE(not substantion equivalent) 의 결과가 나오는 것이다. 510k 절차는 기존 기기와 유사함을 보이는 절차로, 기존 기기와 동등하다=승인 이라는 의미이다.
이 절차는 제출일로부터 대략 90일 정도가 걸린다.(하지만 이는 정해진것이 아니라 더 빠를 수도, 혹은 매우 늦어질 수도 있다)
5. Decistion letter에서 끝날거같지만, 아니다.

100일까지도 최종 결론에 이르지 못하면, missed MDUFA communication 을 보낸다고한다. 이는 예상 일정 이후에도 검토가 필요할 경우 제출자와 대면미팅이나 전화로 검토를 계속 진행하여 최종 결론을 내도록 하는 절차이다.
어떤 기기는 쉽게 검토 결과를 도출할 수 있겠지만, 어떤 기기는 어려울 것이다. 그러므로 정해진 일정에 무조건 끝나지는 않는것이다.
하지만 나도 그랬고 시장도 그랬고 9월말 제출후 100일이 지나도 결과가 나오지 않자 불안감이 커져갔다. 23년 1월 초가 100일이 지난 시점이었는데 그때부터 주가 추이를 보자면
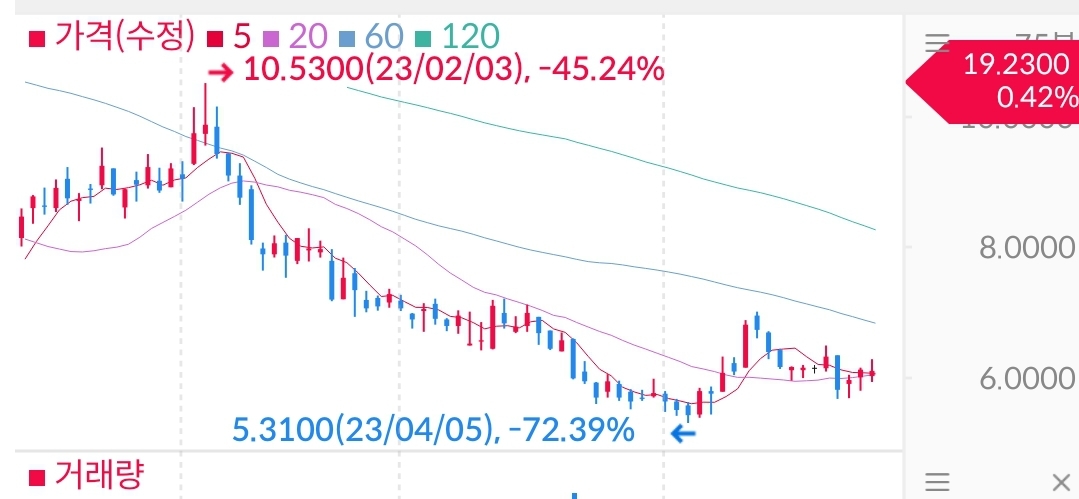
10달러에서 5달러까지 그야말로 승인 전까지 반토막이 나버렸다.
4월달의 경우 나녹스 초기 투자자이면서 나녹스관련 좋은 정보를 올려주시던 블로거 채담채이아빠 마저도 손절을 하게될 정도로 나녹스에대한 시장의 믿음은 바닥이었고 주가또한 심각하게 빠졌다.
하지만 나는 어떻게든 버텼...다고하고싶지만 홀딩하는것 이외에는 대안이 없었다.
물론 이 글을 쓰는 이 시점에서 돌이켜보면 급락한 다른 종목들로 갈아탔어도 어느정도 회복이 되는 장이 되었긴 하지만, 다른 종목으로 두배, 세배 수익을 낼 자신이 없었기에 그냥 홀딩했던것 같다.
이렇듯 나름대로 FDA 승인 절차에 대해서도 스터디하고 언제 승인이 나나, 아니 승인이 나기는 할까 하던 와중에 드디어 승인 소식이 들려왔다!!!
5부에 계속